
Spisu treści:
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Ostatnio zmodyfikowany 2025-01-22 17:07.
Wyprowadzenie równania Hendersona-Hasselbalcha
- Weźmy reakcję jonizacji słabego kwasu (HA):
- Stała dysocjacji Ka powyższej reakcji będzie wynosić:
- Następnie z równanie (2) wyjmij [H?] po lewej stronie (wyznacz H?):
- Zastąp pH i pKa w równanie (4):
Podobnie, czym jest równanie Hendersona w chemii?
Zaktualizowano 10 sierpnia 2019 r Henderson Hasselbalch równanie jest przybliżonym równanie który pokazuje zależność między pH lub pOH roztworu a pKa lub pKb oraz stosunek stężeń zdysocjowanego chemiczny gatunek.
Podobnie, co oznacza pKa? Kluczowe dania na wynos: Definicja pKa ten pKa wartość jest jedną z metod używanych do wskazać siła kwasu. pKa jest ujemnym logarytmem stałej dysocjacji kwasu lub wartości Ka. Niższy pKa wartość wskazuje na silniejszy kwas. Oznacza to, że niższa wartość wskazuje, że kwas pełniej dysocjuje w wodzie.
Biorąc to pod uwagę, czym jest wzór na pKa?
pKa jest zdefiniowany jako -log10 Ka gdzie Ka = [H+][A-] / [HA]. Z tych wyrażeń można wyprowadzić Henderson-Hasselbalch równanie który jest. pKa = pH + log [HA] / [A-] To mówi nam, że gdy pH = pKa następnie zaloguj [HA] / [A-] = 0, zatem [HA] = [A-] tj. równe ilości obu form.
Czy woda jest buforem?
Woda jest bufor choć biedny. Dzieje się tak, ponieważ H20 jonizuje się, tworząc H30+ i OH-. Aby utworzyć kwasowy bufor buforowy potrzebujesz słabego kwasu ze sprzężoną zasadą. Ponieważ będą obecne jony hydroniowe i wodorotlenowe, tak działa jako bufor ale jest straszny.
Zalecana:
Jak udowodnić prawo wielkich liczb?

WIDEO Wiedz też, jak wyjaśnisz prawo wielkich liczb? ten prawo wielkich liczb stwierdza, że obserwowana średnia próbka z a duży próbka będzie zbliżona do rzeczywistej średniej populacji i będzie się zbliżać, im większa będzie próba.
Jak udowodnić, że linie są równoległe w dowodach?

Po pierwsze, jeśli odpowiednie kąty, kąty znajdujące się w tym samym rogu na każdym skrzyżowaniu, są równe, to linie są równoległe. Po drugie, jeśli naprzemienne kąty wewnętrzne, kąty znajdujące się po przeciwnych stronach linii poprzecznej i wewnątrz linii równoległych, są równe, to linie są równoległe
Jak udowodnić ciągłość?

Definicja: Funkcja f jest ciągła przy x0 w swojej dziedzinie, jeśli dla każdego ϵ > 0 istnieje δ > 0 takie, że gdy x jest w domenie f i |x − x0| < δ, mamy |f(x) − f(x0)| < . Ponownie mówimy, że f jest ciągłe, jeśli jest ciągłe w każdym punkcie swojej dziedziny
Jak udowodnić, że coś jest podstawą?

WIDEO Zapytano również, co stanowi podstawę? W matematyce zbiór B elementów (wektorów) w przestrzeni wektorowej V nazywamy a podstawa , jeśli każdy element V może być zapisany w unikalny sposób jako (skończona) liniowa kombinacja elementów B.
Jak można udowodnić podobieństwo 2 trójkątów, korzystając z postulatu podobieństwa bocznego kąta bocznego SAS?
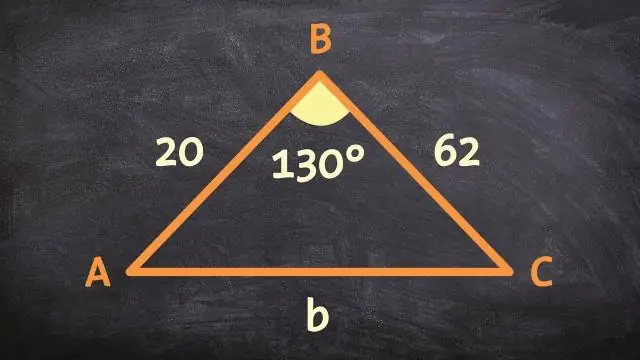
Twierdzenie SAS o podobieństwie mówi, że jeśli dwa boki w jednym trójkącie są proporcjonalne do dwóch boków w innym trójkącie, a kąty zawarte w obu trójkątach są przystające, to oba trójkąty są podobne. Transformacja podobieństwa to jedna lub więcej transformacji sztywnych, po których następuje dylatacja
