
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Ostatnio zmodyfikowany 2025-01-22 17:07.
Prawo Avogadro pokazuje, że istnieje bezpośredni związek między liczbą moli gazu a jego Tom . Można to również pokazać za pomocą równanie: V1/n1 = V2/n2. Jeśli liczba moli zostanie podwojona, Tom podwoi się.
W ten sposób, jaki jest wzór na prawo Avogadro?
Formuła prawa Avogadro Gdzie „V” to objętość gazu, „n” to ilość gazu (liczba moli gazu), a „k” to stała dla danego ciśnienia i temperatury. W rzeczywistości, Prawo Avogadro , postawiona przez niego hipoteza, znalazła się wśród prawa na którym gaz doskonały Prawo jest oparty.
Dodatkowo, jaki jest przykład prawa Avogadro? Prawo Avogadro stwierdza, że objętość gazu jest wprost proporcjonalna do liczby moli gazu. Oto kilka przykłady . Kiedy wysadzasz piłkę do koszykówki, wtłaczasz w nią więcej cząsteczek gazu. Im więcej cząsteczek, tym większa objętość. Oba balony zawierają taką samą liczbę cząsteczek.
Co więcej, co mówi prawo Avogadro, czy to laboratorium udowadnia prawo Skąd wiesz?
Nowoczesna deklaracja jest : Prawo Avogadro stwierdza, że „równe objętości wszystkich gazów, w tej samej temperaturze i ciśnieniu, mają tę samą liczbę cząsteczek”. Dla danej masy an gaz doskonały , objętość i ilość (mole) gazu są wprost proporcjonalny, jeśli temperatura i ciśnienie są stały.
Jak prawo łączenia tomów wyjaśnia Hipoteza Avogadro?
(a) Prawo łączenia tomów za pomocą Hipoteza Avogadro : Wszystkie gazy zawierające równe wolumeny w tych samych warunkach zewnętrznych temperatury i ciśnienia będą miały równą liczbę cząsteczek. Te cząsteczki gazu reagują w stosunkach małych liczb całkowitych, więc ich (gaz) wolumeny będzie również w stosunku małych liczb całkowitych.
Zalecana:
Jak rozwiązać równanie kwadratowe za pomocą prawa czynnika zerowego?

Z tego możemy wywnioskować, że: Jeśli iloczyn dowolnych dwóch liczb wynosi zero, to jedna lub obie liczby są zerowe. Oznacza to, że jeśli ab = 0, to a = 0 lub b = 0 (co obejmuje możliwość, że a = b = 0). Nazywa się to prawem czynnika zerowego; i często go używamy do rozwiązywania równań kwadratowych
Jak wykorzystać metodę przemieszczania wody, aby znaleźć objętość nieregularnego obiektu?

Umieść przedmiot w cylindrze miarowym i zapisz uzyskaną objętość wody jako „b”. Od objętości wody plus obiekt odejmij objętość samej wody. Na przykład, jeśli „b” wynosi 50 mililitrów, a „a” 25 mililitrów, objętość obiektu o nieregularnym kształcie wynosiłaby 25 mililitrów
Jak znaleźć objętość sześcianu z piramidą na górze?
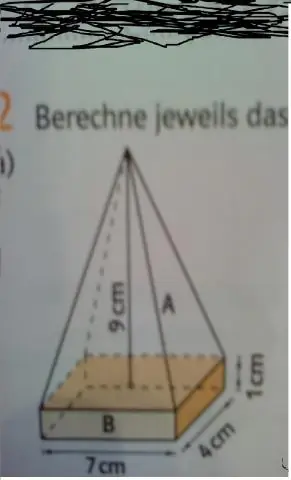
Aby znaleźć objętość tego sześcianu, pomnóż podstawę razy szerokość razy wysokość. Aby obliczyć objętość piramidy, weź pole powierzchni podstawy, egin{align*}Bend{align*} i pomnóż to razy wysokość, a następnie pomnóż przez egin{align*}frac{1}{3}end{ wyrównywać*}
Jak znaleźć pole powierzchni i objętość koła?

Pole powierzchni = (2 • π • r²) + (2 • π • r • wysokość) Gdzie (2 • π • r²) to pole powierzchni „końcówek” i (2 • π • r • wysokość ) to obszar boczny (obszar „boku”)
Jak znaleźć objętość stożka wewnątrz cylindra?

Wzór na objętość cylindra to v = r2h. Objętość stożka o promieniu R i wysokości H wynosi V = 1/3πR2H
