
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Ostatnio zmodyfikowany 2025-01-22 17:07.
Weźmy przykład bufor składa się ze słabej podstawy amoniak , NH3 i jego sprzężony kwas, NH4+. Kiedy HCl (mocny kwas) dodaje się do tego bufor system, dodatkowe jony H+ dodane do systemu są zużywane przez NH3 do Formularz NH4+. Dalsze dodanie kwasu lub zasady do bufor szybko zmieni pH.
Podobnie, czy NH3 i NH4Cl są roztworem buforowym?
Odpowiedź i wyjaśnienie: Amoniak i chlorek amonu bufor jest mieszaniną słabego kwasu i jego soli. To podstawa bufor ponieważ zasadowa stała dysocjacji dla amoniaku jest większa niż stała kwasowa dla jonów amonowych.
Podobnie, jakiego rodzaju reakcją jest HCl i NH3? Zatem NH3 po otrzymaniu H+ z HCl (H+ i Cl-) tworzą NH4+ (jon amonowy), który po związaniu z jonem Cl- (z HCl ) daje NH4Cl (chlorek amonu). ten reakcja jest reprezentowany jako NH3 + HCl = NH4CI.
Pojawia się również pytanie, jaka reakcja zachodzi po dodaniu HCl do buforu amoniakalnego?
chlorowodorek kwas gwałtownie reagowałby z amoniakiem, tworząc chlorek amonu (który jest bardzo słabo kwaśną solą, na ogół nieszkodliwą), neutralizując zasadowość roztworu i można by zaobserwować energiczne tworzenie się pęcherzyków gazowego wodoru w postaci musowania roztworu.
Jak zrobić roztwór buforowy amoniaku?
Amoniak -Chlorek amonu Bufor : rozpuścić 67,5 g chlorku amonu w około 200 ml wody, dodać 570 ml mocnego roztwór amoniaku i rozcieńczyć wodą do 1000 ml. Bufor amoniaku pH 9,5: Rozpuść 33,5 g chlorku amonu w ISO ml wody i 42 ml 10M amoniak i rozcieńczyć wodą do 250 ml.
Zalecana:
Które rozwiązanie to bufor?

Roztwór buforowy to taki, który jest odporny na zmiany pH, gdy dodaje się do niego niewielkie ilości kwasu lub zasady. Kwaśne roztwory buforowe. Kwaśny roztwór buforowy to po prostu taki, który ma pH poniżej 7. Kwaśne roztwory buforowe są zwykle wytwarzane ze słabego kwasu i jednej z jego soli – często soli sodowej
Dlaczego bufor działa najlepiej przy pH zbliżonym do jego pKa?
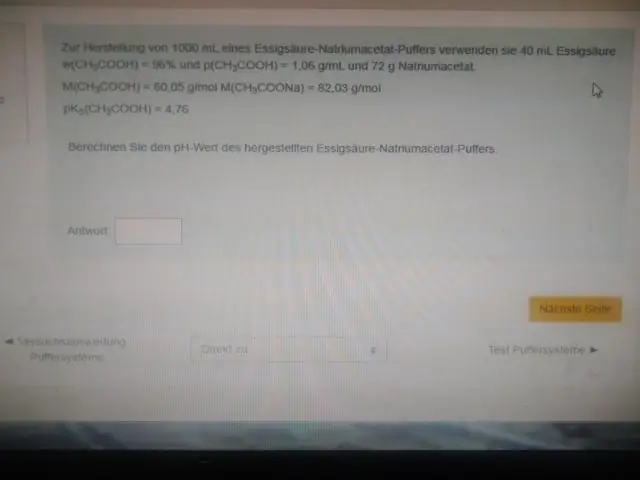
Innymi słowy, pH równomolowego roztworu kwasu (np. gdy stosunek stężenia kwasu i sprzężonej zasady wynosi 1:1) jest równe pKa. Region ten jest najbardziej skuteczny w przeciwdziałaniu dużym zmianom pH po dodaniu kwasu lub zasady. Krzywa miareczkowania wizualnie pokazuje pojemność buforową
Jak zrobić bufor węglanowo-wodorowęglanowy?

Receptura i przygotowanie buforu węglanowo-wodorowęglanowego (pH 9,2 do 10,6) Przygotuj 800 ml wody destylowanej w odpowiednim pojemniku. Do roztworu dodać 1,05 g wodorowęglanu sodu. Do roztworu dodać 9,274 g węglanu sodu (bezwodnego). Dodaj wodę destylowaną do objętości 1 l
Czy mocny kwas i słaba zasada mogą stanowić bufor?

Jak zauważyłeś przy obliczaniu pH roztworów, tylko niewielka ilość mocnego kwasu jest potrzebna do drastycznej zmiany pH. Bufor to po prostu mieszanina słabego kwasu i jego sprzężonej zasady lub słabej zasady i jej sprzężonego kwasu. Bufory działają poprzez reakcję z dowolnym dodanym kwasem lub zasadą w celu kontrolowania pH
Czym jest bufor Khan Academy?

O transkrypcji. Roztwór buforowy zawiera mieszaninę słabego kwasu i jego sprzężonej zasady (lub słabej zasady i jej sprzężonego kwasu). Równowaga między słabym kwasem a jego sprzężoną zasadą pozwala, aby roztwór był odporny na zmiany pH po dodaniu niewielkich ilości mocnego kwasu lub zasady
