
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Ostatnio zmodyfikowany 2025-06-01 05:05.
dwa
W związku z tym, które elementy są wyjątkami od zasady Aufbau?
Na przykład ruten, rod, srebro i platyna to wszystko wyjątki od zasady Aufbau z powodu wypełnionych lub częściowo wypełnionych podpowłok.
Poza powyższym, dlaczego konfiguracja elektronów dla miedzi jest 1s22s22p63s23p63d104s1 zamiast 1s22s22p63s23p63d94s2? Wypełniony podpoziom jest bardziej stabilny niż podpoziom wypełniony do połowy. Układ elektrony przy takim samym obrocie jest jak najmniejsza. Orbital 4s ma wyższą energię niż orbital 3d.
Zapytany również, jak piszesz konfigurację elektronową dla elementów bloku D?
Ogólnie rzecz biorąc, elektroniczna Konfiguracja tych elementy jest (n-1) D 1-10ns 1-2. (n-1) pozostaje dla wewnętrznego D Orbitale, które mogą mieć od jednego do dziesięciu elektronów, a orbital obwodowy ns mogą mieć jeden lub dwa elektrony. ten D - blok obejmuje środkowy obszar otoczony przez s- i p- Bloki w układzie okresowym.
Dlaczego Cr i Cu mają nieregularną konfigurację?
To samo dzieje się z Cu . My Móc zobacz to w Cu d podpowłoka ma 9 elektronów, więc aby stać się stabilnym potrzebuje 1 elektronu więcej w podpowłoce d, więc pobierze 1 elektron z podpowłoki s i teraz Cu ustabilizuje się w nowej elektronice konfiguracja . Stąd, Cr i Cu są nazywany wyjątkowym konfiguracja.
Zalecana:
Ile elektronów jest w kobalcie?

27 elektronów
Jaka jest liczba atomowa germanu, ile elektronów ma german?

Nazwa Masa atomowa germanu 72,61 jednostka masy atomowej Liczba protonów 32 Liczba neutronów 41 Liczba elektronów 32
Jaki jest związek konfiguracji elektronów z liczbami kwantowymi?
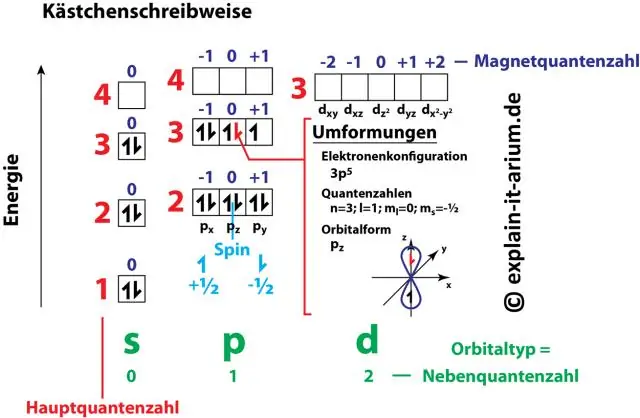
Pary cyfr i liter w konfiguracji elektronowej reprezentują dwie z czterech liczb kwantowych elektronu. Te liczby kwantowe dostarczają nam więcej informacji o właściwościach elektronów i ich orbitali. Główna liczba kwantowa (n) mówi nam o poziomie energii elektronu i jego rozmiarze
Ile pojedynczych elektronów jest wspólnych w podwójnym wiązaniu?

W wiązaniu kowalencyjnym para elektronów jest podzielona między dwa atomy „połączone” wiązaniem kowalencyjnym. Tak więc wiązanie podwójne kowalencyjne ma dwie pary elektronów współdzielone, więc w sumie cztery elektrony
Jak wypada porównanie konfiguracji elektronów w tej samej grupie pierwiastków?

Jak wypada porównanie konfiguracji elektronów w tej samej grupie pierwiastków? Pierwiastki w tej samej grupie mają te same konfiguracje elektronów walencyjnych. Oznacza to, że mają całkowicie wypełnione podpoziomy s i p, co daje im „stabilny oktet” elektronów na ich zewnętrznym poziomie
