
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Ostatnio zmodyfikowany 2025-01-22 17:07.
Odpowiedź i wyjaśnienie:
Fosfor ma 16 neutronów . Fosfor jest 15 w układzie okresowym pierwiastków, co oznacza, że liczba atomowa (liczba protonów) fosforu wynosi 15.
Pojawia się również pytanie, ile neutronów jest w fosforze?
16 neutronów
Następnie pojawia się pytanie, ile izotopów znajduje się w fosforze? Izotopy z fosfor . Mimo że fosfor (15P) ma 23 izotopy z 25P do 47P, tylko 31P jest stabilny; takie jak, fosfor jest uważany za element monoizotopowy. Najdłużej żyjący radioaktywny izotopy są 33P z okresem półtrwania 25,34 dni i 32P z okresem półtrwania 14,263 dni.
W konsekwencji, ile neutronów ma fosfor 32?
17 neutronów
Jaka jest liczba masowa fosforu z 16 neutronami?
| Nazwa | Fosfor |
|---|---|
| Masa atomowa | 30,974 jednostek masy atomowej |
| Liczba protonów | 15 |
| Liczba neutronów | 16 |
| Liczba elektronów | 15 |
Zalecana:
Ile protonów, neutronów i elektronów ma 58 28ni?
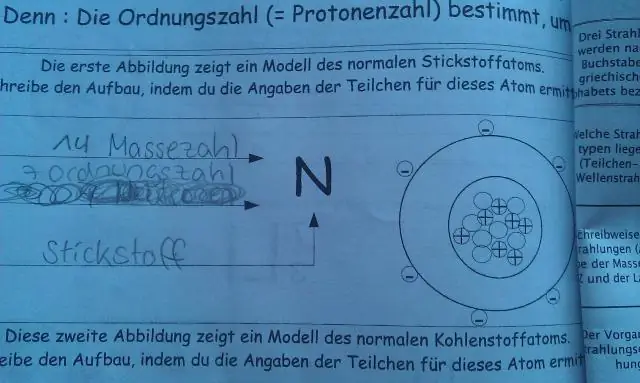
Ni-58 ma liczbę atomową 28 i liczbę masową 58. Zatem Ni-58 będzie miał 28 protonów, 28 elektronów i 58-28 lub 30 neutronów. W gatunkach Ni-60 2+ liczba protony są takie same jak w neutralnym Ni-58
Ile neutronów znajduje się w atomie RA 288?

Jądro składa się z 88 protonów (czerwony) i 138 neutronów (pomarańczowy)
Ile protonów, neutronów i elektronów ma chrom?

Chrom jest pierwszym pierwiastkiem w szóstej kolumnie układu okresowego. Jest klasyfikowany jako metal przejściowy. Atomy chromu mają 24 elektrony i 24 protony, przy czym najobfitszy izotop ma 28 neutronów
Ile neutronów znajduje się w atomie chromu o liczbie masowej 54?

Chrom 54: liczba atomowa Z = 24, więc są 24 protony i 24 elektrony. Liczba masowa A = 54. Liczba neutronów = A – Z = 54 – 24 = 30
Ile protonów, neutronów i elektronów ma arszenik?

Schemat składu jądrowego i konfiguracji elektronowej atomu arsenu-75 (liczba atomowa: 33), najpowszechniejszego izotopu tego pierwiastka. Jądro składa się z 33 protonów (czerwony) i 42 neutronów (niebieski). 33 elektrony (zielony) wiążą się z jądrem, kolejno zajmując dostępne powłoki elektronowe (pierścienie)
