
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Ostatnio zmodyfikowany 2025-01-22 17:07.
ten entalpia tworzenia na element w stanie elementarnym zawsze będzie 0 ponieważ nie wymaga energii, aby utworzyć naturalnie występujący związek. Kiedy substancja jest uformowany z najstabilniejszej jego formy elementy , zmiana w entalpia ma miejsce.
Podobnie można zapytać, jakie substancje mają entalpię tworzenia zerową?
Wszystkie pierwiastki w ich stanach standardowych (gaz tlenowy, ciało stałe węgiel w postaci grafit , itp.) mają standardową entalpię tworzenia zerową, ponieważ nie ma żadnej zmiany w ich tworzeniu.
Następnie pojawia się pytanie, jaka jest entalpia tworzenia wody? Wybrana entalpia tworzenia ATcT na podstawie wersji 1.118 sieci termochemicznej
| Nazwa gatunku | Formuła | ΔFH° (298,15 K) |
|---|---|---|
| Woda | H2O (cr, eq.press.) | -292.740 |
W związku z tym, dlaczego standardowa entalpia powstawania diamentu nie jest równa zeru, mimo że jest to pierwiastek?
ten standardowa entalpia tworzenia , na element w swoim standard stan jest ZERO !!!! Zatem ΔH°f dla C (s, grafit) to zero , ale ΔH°f dla C (s, diament ) wynosi 2 kJ/mol. To dlatego, że grafit jest standard stan dla węgla, nie diament.
Co to znaczy, gdy Delta h wynosi zero?
Mogą jedynie mierzyć zmiany entalpii. Kiedy entalpia jest dodatnia i delta H jest większy niż zero , ten znaczy że system pochłonął ciepło. Nazywa się to reakcją endotermiczną. Kiedy entalpia jest ujemna i delta H jest mniej niż zero , ten znaczy że system uwolnił ciepło. Nazywa się to reakcją egzotermiczną.
Zalecana:
Dlaczego indukowane emf wynosi zero, gdy strumień magnetyczny jest maksymalny?

Gdy cewka jest w pozycji pionowej, nie ma zmiany strumienia magnetycznego (tj. emf = 0), ponieważ cewka nie „przecina” linii pola. Indukowane emf wynosi zero, gdy cewki są prostopadłe do linii pola i maksimum, gdy są równoległe. Pamiętaj, że indukowane emf to szybkość zmian w połączeniu strumienia magnetycznego
Dlaczego pole elektromagnetyczne wynosi zero, gdy cewka przechodzi przez dokładny środek magnesu?
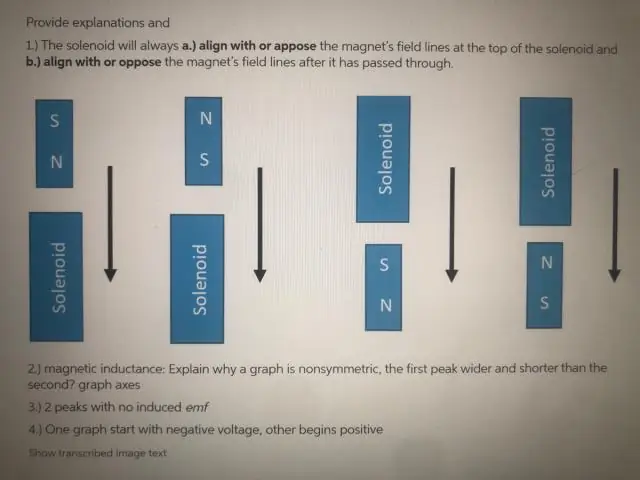
Siła emf wynosi tylko zero przez chwilę, gdy magnes przechodzi przez dokładny środek cewki. Dzieje się tak, ponieważ efekt bieguna N na jednym końcu magnesu na tym końcu cewki jest dokładnie niwelowany przez efekt bieguna S magnesu na drugim końcu cewki
Jaka jest standardowa entalpia tworzenia dwutlenku siarki?

Aby to sprawdzić, powinno wynosić (−296.81±0.20) kJ/mol. Powinieneś częściej używać NIST. W rzeczywistości mam jednak −310,17 kJ/mol. Musisz najpierw wyszukać ΔH∘f dla SO3(g)
Jaka jest entalpia tworzenia Cao?

Tabela ciepła tworzenia związku ΔHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Ile wynosi 114 w układzie okresowym pierwiastków?

Flerovium to superciężki sztuczny pierwiastek chemiczny o symbolu Fl i liczbie atomowej 114. Jest to niezwykle radioaktywny pierwiastek syntetyczny. Pierwiastek nosi nazwę Laboratorium Reakcji Jądrowych Flerowa Wspólnego Instytutu Badań Jądrowych w Dubnej w Rosji, gdzie pierwiastek odkryto w 1998 roku
