
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Ostatnio zmodyfikowany 2025-01-22 17:07.
chlor izotop z 18 neutronami ma obfitość 0,7577 i liczbę masową 35 amu. Aby obliczyć przeciętny masa atomowa, pomnóż ułamek przez liczbę masową dla każdego izotop , a następnie dodaj je razem.
Podobnie, jaka jest średnia ważona wszystkich izotopów pierwiastka?
Korzystanie z mas różnych izotopy i jak obfite każdy? izotop jest, możemy znaleźć przeciętny masa atomów an element . Masa atomowa an element jest Średnia ważona masa atomów w naturalnie występującej próbce element . Masę atomową podaje się zazwyczaj w jednostkach masy atomowej.
co ma masę 1 amu? Jednostka masy atomowej (symbolizowana AMU lub amu) jest zdefiniowana jako dokładnie 1/12 masy atomu węgla-12. Atom węgla-12 (C-12) ma sześć protony i sześć neutrony w jej jądrze. Mówiąc nieprecyzyjnie, jeden AMU to średnia z proton masa spoczynkowa i neutron masa spoczynkowa.
Po drugie, jak obliczyć procentową obfitość za pomocą masy atomowej?
Zmień każdy procent obfitości na postać dziesiętną dzieląc przez 100. Pomnóż tę wartość przez masa atomowa tego izotopu. Dodaj razem dla każdego izotopu, aby uzyskać średnią masa atomowa.
Jaka jest różnica między masą atomową a masą atomową?
Masa atomowa (ma) jest masa z an atom . Pojedynczy atom ma określoną liczbę protonów i neutronów, więc masa jest jednoznaczny (nie zmieni się) i jest sumą liczby protonów i neutronów w atomie . Masa atomowa jest średnią ważoną wartości masa ze wszystkich atomy pierwiastka, w oparciu o obfitość izotopów.
Zalecana:
Jak znaleźć średnią prędkość przy dwóch prędkościach?
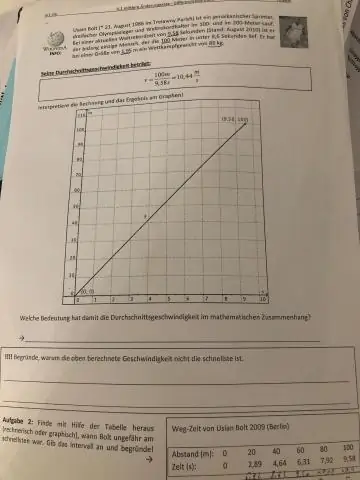
Suma prędkości początkowej i końcowej jest dzielona przez 2, aby znaleźć średnią. Kalkulator średniej prędkości wykorzystuje wzór, który pokazuje, że średnia prędkość (v) jest równa sumie prędkości końcowej (v) i prędkości początkowej (u), podzielonej przez 2
Jak interpretujesz średnią ważoną?

Streszczenie. Średnia ważona: średnia, w której niektóre wartości mają większy wkład niż inne. Gdy wagi dodają do 1: po prostu pomnóż każdą wagę przez pasującą wartość i zsumuj wszystko. W przeciwnym razie pomnóż każdą wagę w przez odpowiadającą jej wartość x, zsumuj wszystkie i podziel przez sumę wag: Średnia ważona = ΣwxΣw
Jak znaleźć brakującą liczbę, gdy podano średnią?

Średnia zbioru liczb jest średnią tych liczb. Możesz znaleźćthemean, dodając zbiór liczb i dzieląc przez ile liczb jest podanych. Jeśli otrzymasz średni temat i zostaniesz poproszony o znalezienie brakującej liczby ze zbioru, użyj prostego równania
Jak stworzyć średnią ważoną w tabeli przestawnej?

Średnie ważone w tabeli przestawnej Kliknij strzałkę w dół obok słowa Tabela przestawna po lewej stronie paska narzędzi tabeli przestawnej. Wybierz formuły | Pola obliczeniowe. W polu Nazwa wprowadź nazwę nowego pola. W polu Formuła wprowadź formułę, której chcesz użyć dla średniej ważonej, na przykład =WartośćWaga/Waga. Kliknij OK
Jaka jest średnia ważona masa?

Masa atomowa pierwiastka jest średnią ważoną mas izotopów pierwiastka. Masę atomową pierwiastka można obliczyć pod warunkiem, że znane są względne ilości naturalnie występujących izotopów pierwiastka i masy tych izotopów
